
Ch biên: Th y giáo : Nguy n Xuân Tr ngủ ầ ễ ườ
Sách giáo khoa hoá h c 10ọ
I. C u t o nguyên tấ ạ ử
1. Thành ph n c u t o c a nguyên t . Kích th c, kh i l ng nguyên tầ ấ ạ ủ ử ướ ố ượ ử
a) Thành ph n c u t o c a nguyên tầ ấ ạ ủ ử
1. L p vớ ỏ
G m các h t mang đi n âm g i là ồ ạ ệ ọ electron (hay đi n t ). Kh i l ng c a các electron đ uệ ử ố ượ ủ ề
b ng nhau và x p x b ng 1/1840 kh i l ng c a nguyên t hiđro là nguyên t nh nh t, t cằ ấ ỉ ằ ố ượ ủ ử ử ẹ ấ ứ
là b ng: mằe = 9,1095.10-31 kg hay b ng 0,00055 đ n v Cacbon (đv.C).ằ ơ ị
Đi n tích c a các electron đ u b ng nhau và b ng -1,6.10ệ ủ ề ằ ằ -19 Culông.
Đó là đi n tích nh nh t, vì v y đ c g i là đi n tích nguyên t .ệ ỏ ấ ậ ượ ọ ệ ố
2. H t nhânạ
H t nhân nguyên t g m các h t proton và n tron.ạ ử ồ ạ ơ
Proton. Proton có đi n tích đúng b ng đi n tích c a electron nh ng ng c d u t c là b ngệ ằ ệ ủ ư ượ ấ ứ ằ
+1,6.10-19 Culông.
Nh v y proton và electron cùng mang m t đi n tích nguyên t , có d u ng c nhau. Đư ậ ộ ệ ố ấ ượ ể
thu n ti n, ng i ta quy c l y đi n tích nguyên t làm đ n v , coi đi n tích c a electron làậ ệ ườ ướ ấ ệ ố ơ ị ệ ủ
1- và đi n tích c u proton là 1+.ệ ả
N tronơ. H t n tron không mang đi n, có kh i l ng x p x b ng kh i l ng c a proton vàạ ơ ệ ố ượ ấ ỉ ằ ố ượ ủ
b ng:ằ
mp = mn = 1,67.10-27 kg
hay x p x b ng 1 đv.C.ấ ỉ ằ
b) Kích th c, kh i l ng c a nguyên tướ ố ượ ủ ử
Kích th cướ : N u hình dung nguyên t nh m t kh i c u thì nó có đ ng kính kho ng 10ế ử ư ộ ố ầ ườ ả -10
m. Đ bi u th kích th c nguyên t , ng i ta dùng m t đ n v là Angxtrom và kí hi u là Åể ể ị ướ ử ườ ộ ơ ị ệ
1Å = 10-10 m hay 1Å = 10-8 cm
Nguyên t nh nh t là hiđro có bán kính kho ng 0,53 Å.ử ỏ ấ ả
Đ ng kính c a h t nhân nguyên t còn nh h n, vào kho ng 10ườ ủ ạ ử ỏ ơ ả -4 Å, nh v y đ ng kínhư ậ ườ
c a nguyên t l n h n đ ng kính c a h t nhân kho ng 10.000 l n.ủ ử ớ ơ ườ ủ ạ ả ầ
Ta t ng t ng n u phóng đ i m t nguyên t vàng lên 10ưở ượ ế ạ ộ ử 9 l n (m t t l n !) thì nó cóầ ộ ỉ ấ
đ ng kính là 30 cm nghĩa là nguyên t v a b ng qu bóng r . Trong khi đó thì h t nhânườ ử ừ ằ ả ổ ạ
nguyên t vàng có m t đ ng kính nh h n 0,003 cm nghĩa là có kích th c c a m t h t cátử ộ ườ ỏ ơ ướ ủ ộ ạ
nh .ỏ
B ng - ảKh i l ng và đi n tích c a các h t c u t o nên nguyên tố ượ ệ ủ ạ ấ ạ ử
Tên Kí hi uệKh i l ngố ượ Đi n tíchệ
Electron e me = 9,1095 × 10 −31 kg me ≈ 0,549
× 10 −3 đv.C -1,602.10-19 C
Proton p mp = 1,6726 × 10 −27 kg mp ≈ 1đv.C +1,602.10-19 C
N tronơnmn = 1,6750 × 10 −27 kg mn ≈ 1đv.C 0

Đ ng kính c a electron và proton l i còn nh h n nhi u : kho ng 10ườ ủ ạ ỏ ơ ề ả -7 Å. Electron chuy nể
đ ng xung quanh h t nhân. Gi a electron và h t nhân là chân không : t đó ta th y nguyên tộ ạ ữ ạ ừ ấ ử
có c u t o r ng !ấ ạ ỗ
Kh i l ngố ượ : Kh i l ng c a m t nguyên t vào kho ng 10ố ượ ủ ộ ử ả -26 kg. Nguyên t nh nh t là hiđroử ẹ ấ
có kh i l ng là 1,67.10ố ượ -27 kg. Kh i l ng c a nguyên t cacbon là 1,99.10ố ượ ủ ử -26 kg.
M t l ng ch t r t nh cũng ch a m t s nguyên t l n t i m c ta khó mà hình dung đ c. ộ ượ ấ ấ ỏ ứ ộ ố ử ớ ớ ứ ượ
Ví dụ : Trong 2 gam cacbon có1023 nguyên t cacbon. M t lít n c cũng ch a t i kho ngử ộ ướ ứ ớ ả
9.1025 nguyên t hiđro và oxi.ử
2. H t nhân nguyên t - Nguyên t hoá h c - Đ ng vạ ử ố ọ ồ ị
a) H t nhân nguyên tạ ử
1. Đi n tích h t nhân ệ ạ
Vì đi n tích c a m i proton b ng m t đ n v đi n tích d ng (1+) nên trong h t nhân n uệ ủ ỗ ằ ộ ơ ị ệ ươ ạ ế
có Z proton, thì đi n tích c a h t nhân s là Z+. Th c nghi m cho bi t nguyên t trung hoàệ ủ ạ ẽ ự ệ ế ử
đi n nên s proton trong h t nhân b ng s electron chuy n đ ng quanh h t nhân. Nh v t,ệ ố ạ ằ ố ể ộ ạ ư ậ
trong nguyên t :ử
Đi n tích h t nhân = S proton = S electronệ ạ ố ố
Ví dụ: Đi n tích h t nhân nguyên t oxi là 8+, nh v y nguyên t oxi có 8 proton và có 8ệ ạ ử ư ậ ử
electron. Bi t đ c đi n tích h t nhân nguyên t (cũng nh bi t đ c s proton và sế ượ ệ ạ ử ư ế ượ ố ố
electron) t c là n m đ c chìa khóa đ nh n bi t nguyên t .ứ ắ ượ ể ậ ế ử
2. S kh iố ố
T ng s h t proton (kí hi u là Z) và t ng s h t h t n tron (kí hi u là N) trong h t nhân g iổ ố ạ ệ ổ ố ạ ạ ơ ệ ạ ọ
là s kh iố ố c a h t nhân đó (kí hi u là A).ủ ạ ệ
A = Z + N
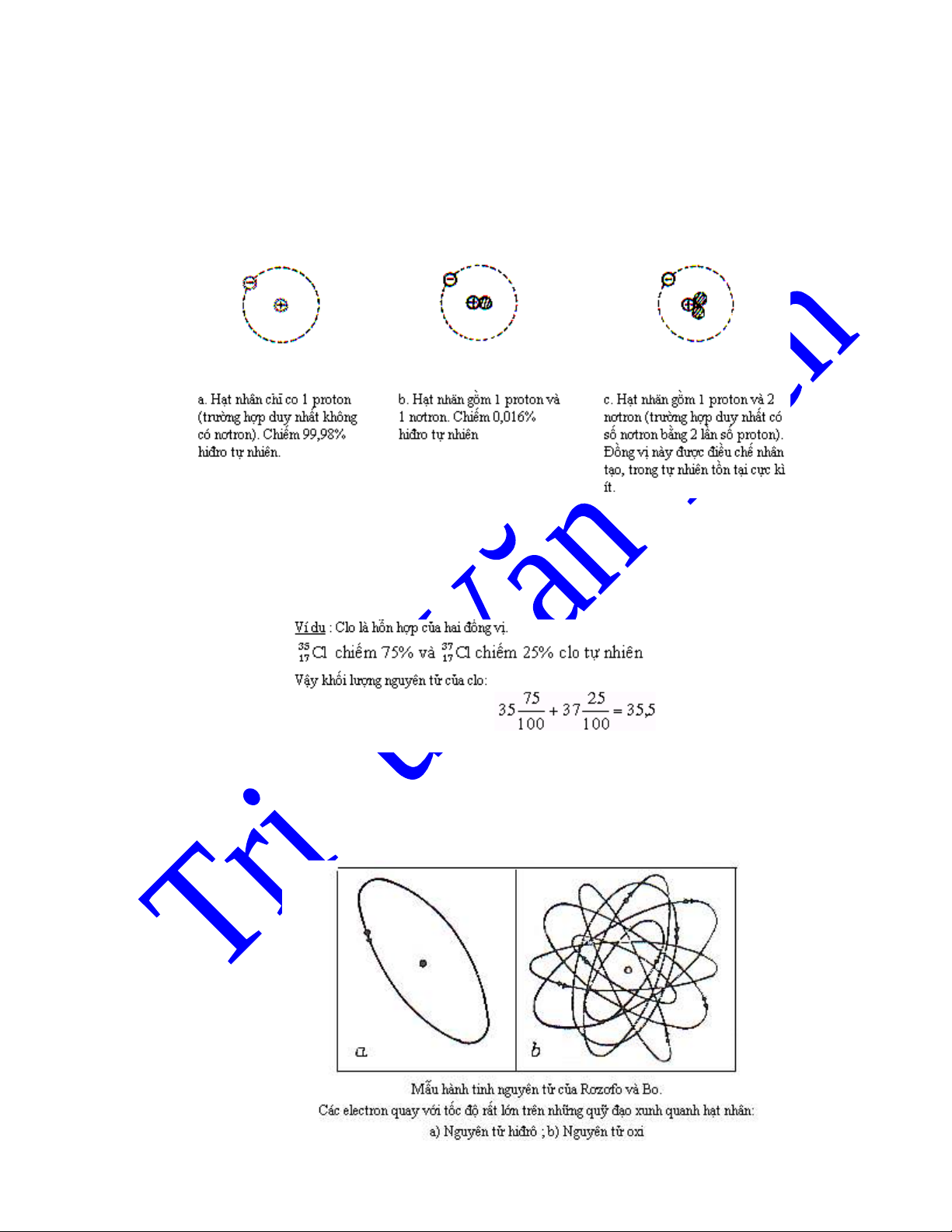
Ví dụ: Trong h t nhân nguyên t clo có 17 proton và 18 n tron, v y s kh i c a h t nhânạ ử ơ ậ ố ố ủ ạ
nguyên t clo là: 17 + 18 = 35.ử
3. Kh i l ng nguyên tố ượ ử
Kh i l ng c a nguyên t b ng t ng kh i l ng c a proton, n tron và electron có trongố ượ ủ ử ằ ổ ố ượ ủ ơ
nguyên t . Nh ng vì kh i l ng c a electron r t nh so v i kh i l ng c a proton và n tronử ư ố ượ ủ ấ ỏ ớ ố ượ ủ ơ
nên kh i l ng c a nguyên t coi nh b ng kh i l ng c a các proton và n tron trong h tố ượ ủ ử ư ằ ố ượ ủ ơ ạ
nhân nguyên t .ử
Ví dụ: H t nhân c a nguyên t nhôm có 13 proton và 14 n tron, xung quanh h t nhân có 13ạ ủ ử ơ ạ
electron. Xác đ nh kh i l ng nguyên t nhôm.ị ố ượ ử
Kh i l ng c a nguyên t nhôm coi nh b ng kh i l ng c a 13 proton và 14 n tron. Kh iố ượ ủ ử ư ằ ố ượ ủ ơ ố
l ng c a m i proton và m i n tron x p x b ng 1 đv.C. V y kh i l ng nguyên t nhômượ ủ ỗ ỗ ơ ấ ỉ ằ ậ ố ượ ử
b ng 27 đv.C.ằ
Nh v y, h t nhân tuy r t nh so v i c nguyên t nh ng l i t p trung đó h u nh toànư ậ ạ ấ ỏ ớ ả ử ư ạ ậ ở ầ ư
b kh i l ng c a nguyên t .ộ ố ượ ủ ử
b) Nguyên t hoá h cố ọ
1. Đ nh nghĩaị
T t c các nguyên t có cùng đi n tích h t nhân đ u thu c cùng m t nguyên t hoá h c.ấ ả ử ệ ạ ề ộ ộ ố ọ
Nh v y, các nguyên t c a cùng m t nguyên t hoá h c có cùng s proton và cùng sư ậ ử ủ ộ ố ọ ố ố
electron.
Ví dụ : T t c các nguyên t có cùng đi n tích h t nhân là 17+ đ u thu c nguyên t clo. Cácấ ả ử ệ ạ ề ộ ố
nguyên t c a nguyên t clo đ u có 17 proton và 17 electron.ử ủ ố ề
Cho đ n nay, ng i ta đã bi t 92 nguyên t t nhiên và kho ng 17 nguyên t nhân t o (t ngế ườ ế ố ự ả ố ạ ổ
s kho ng 109 nguyên t ). Các nguyên t nhân t o ch a đ c phát hi n th y trên Trái Đ tố ả ố ố ạ ư ượ ệ ấ ấ
hay b t kì n i nào khác trong vũ tr mà đ c đi u ch trong phòng thí nghi m.ấ ơ ụ ượ ề ế ệ
Tính ch t c a m t nguyên t hoá h c là tính ch t c a t t c các nguyên t c a nguyên tấ ủ ộ ố ọ ấ ủ ấ ả ử ủ ố
đó.
2. S hi u nguyên tố ệ ử
Đi n tích h t nhân nguyên t c a m t nguyên t đ c g i là ệ ạ ử ủ ộ ố ượ ọ s hi u nguyên t ố ệ ử c a nguyênủ
t đó.ố
S hi u nguyên t đ c tr ng cho m t nguyên t hoá h c và th ng đ c kí hi u là Z.ố ệ ử ặ ư ộ ố ọ ườ ượ ệ
Ví dụ : S hi u nguyên t c a nguyên t urani là 92. V y : đi n tích h t nhân nguyên tố ệ ử ủ ố ậ ệ ạ ử
urani là 92+ ; có 92 proton trong h t nhân và 92 electron ngoài l p v .ạ ớ ỏ
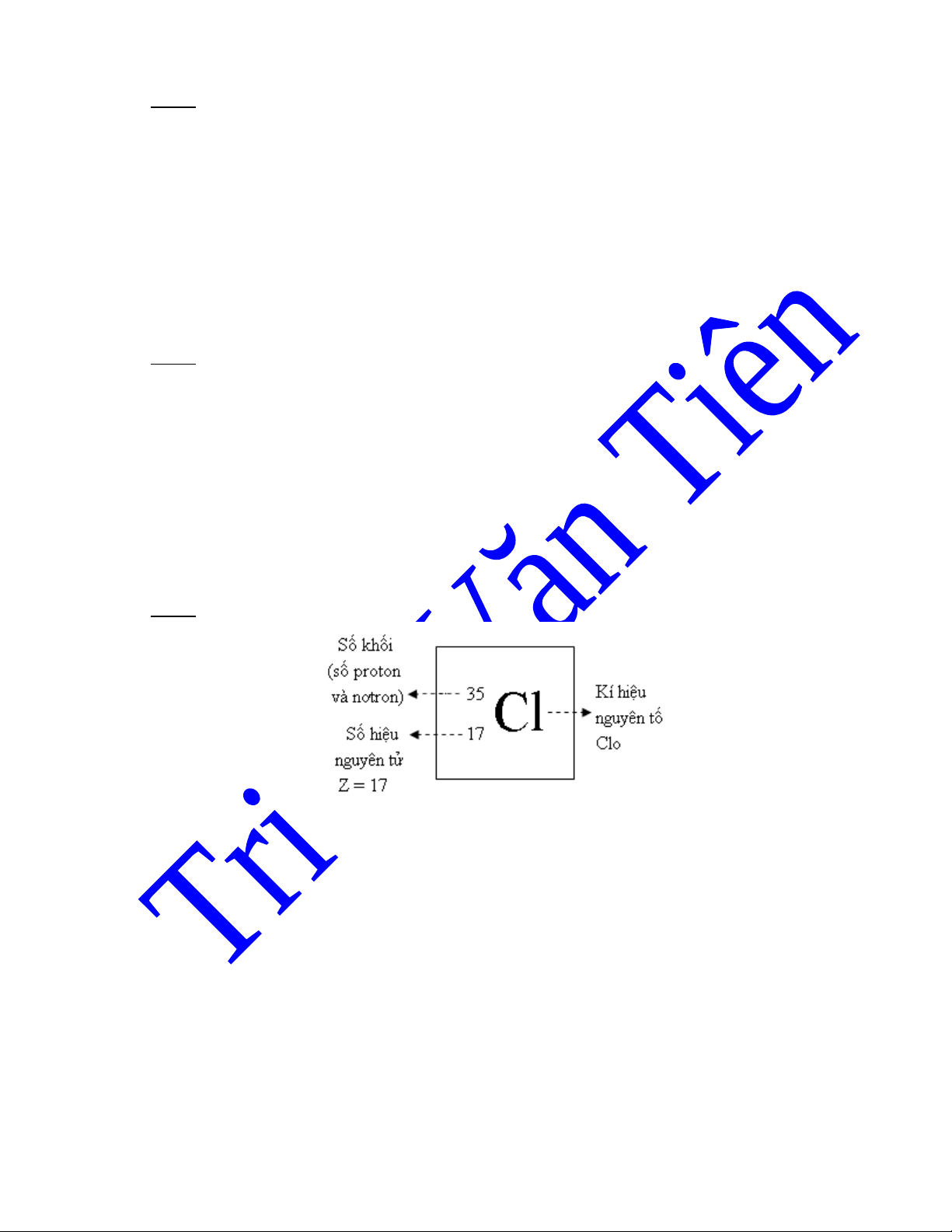
3. Kí hi u các nguyên tệ ử
Đ đ c tr ng đ y đ cho m t nguyên t hoá h c, bên c nh kí hi u th ng dùng, ng i taể ặ ư ầ ủ ộ ố ọ ạ ệ ườ ườ
còn ghi các ch d n sauỉ ẫ
A
Z
X
X : kí hi u c a nguyên tệ ủ ố
Z : s hi u nguyên tố ệ ử
A : s kh i A = Z + Nố ố
Ví dụ :
T kí hi u trên ta có th bi t đ c :ừ ệ ể ế ượ
- S hi u nguyên t c a nguyên t clo là 17 ; đi n tích h t nhân nguyên t là 17+ ; trong h tố ệ ử ủ ố ệ ạ ử ạ
nhân có 17 proton và (35 - 17) = 18 n tron.ơ
- Nguyên t clo có 17 electron chuyên đ ng quanh nhân.ử ộ
- Kh i l ng nguyên t c a clo là 35 đv.C.ố ượ ử ủ
c) Đ ng vồ ị
Khi nghiên c u các nguyên t c a cùng m t nguyên t hoá h c, ng i ta th y r ng trongứ ử ủ ộ ố ọ ườ ấ ằ
h t nhân c a nh ng nguyên t đó, s proton đ u nh nhau nh ng s kh i có th khác nhau doạ ủ ữ ử ố ề ư ư ố ố ể
s n tron khác nhau.ố ơ
Ng i ra g i nh ng nguyên t có cùng s proton nh ng khác nhau v s n tron là nh ngườ ọ ữ ử ố ư ề ố ơ ữ
đ ng vồ ị.
Ch ng h n oxi có ba đ ng v : ẳ ạ ồ ị
C ba đ ng v đ u có 8 proton trong h t nhân nh ng s n tron l n l t là 8, 9, 10.ả ồ ị ề ạ ư ố ơ ầ ượ
H u h t các nguyên t hoá h c là h n h p c a nhi u đ ng v , ch có vài nguyên t có m tầ ế ố ọ ỗ ợ ủ ề ồ ị ỉ ố ộ
đ ng v . Ngoài nh ng đ ng v t n t i trong t nhiên (kho ng 300), ng i ta còn đi u chồ ị ữ ồ ị ồ ạ ự ả ườ ề ế
đ c các đ ng v nhân t o (kho ng 1000).ượ ồ ị ạ ả
Còn nhi u đ ng v có ng d ng quan tr n trong vi c s d ng năng l ng h t nhân nguyênề ồ ị ứ ụ ọ ệ ử ụ ượ ạ
t nh đ ng v ử ư ồ ị c a hiđro (g i là đ teri) đ ng v ủ ọ ơ ồ ị c a urani (g i là urani 235).ủ ọ
Các đ ng v c a cùng m t nguyên t có tính ch t hoá h c gi ng nhau.ồ ị ủ ộ ố ấ ọ ố
Đ i v i nguyên t hiđro, ng i ta bi t ba đ ng vố ớ ố ườ ế ồ ị
Kh i l ng nguyên t trung bình c a các nguyên t hoá h cố ượ ử ủ ố ọ .
Vì h u h t các nguyên t hoá h c là h n h p c a nhi u đ ng v nên kh i l ng nguyên tầ ế ố ọ ỗ ợ ủ ề ồ ị ố ượ ử
c a các nguyên t đó là kh i l ng nguyên t trung bình c a h n h p các đ ng v có k đ n tủ ố ố ượ ử ủ ỗ ợ ồ ị ể ế ỉ
l ph n trăm c a m i đ ng v .ệ ầ ủ ỗ ồ ị
3. V nguyên tỏ ử
a) S chuy n đ ng c a electron trong nguyên tự ể ộ ủ ử

Lúc đ u ng i ta cho r ng các electron chuy n đ ng xung quanh h tầ ườ ằ ể ộ ạ
nhân nguyên t theo nh ng qu đ o hình tròn hay b u d c nh quử ữ ỹ ạ ầ ụ ư ỹ
đ o c a các hành tinh chuy n đ ng xung quanh M t tr i - m u hànhạ ủ ể ộ ặ ờ ẫ
tinh nguyên t c a R z fo-Bo (Rutherford-Bohr).ử ủ ơ ơ
M u R z fo-Bo đã có nh h ng r t l n đ n s phát tri n líẫ ơ ơ ả ưở ấ ớ ế ự ể
thuy t c u t o nguyên t , nh ng nó t ra không đ y đ đ gi iế ấ ạ ử ư ỏ ầ ủ ể ả
thích m i tính ch t c a nguyên t .ọ ấ ủ ử
V sau, nh công trình nghiên c u c a nhi u nhà bác h c ng i taề ờ ứ ủ ề ọ ườ
bi t r ng chuy n đ ng c a electron trong nguyên t không theo m tế ằ ể ộ ủ ử ộ
qu đ o xác đ nh.ỹ ạ ị
Electron là m t phân t mang đi n, l i chuy n đ ng r t nhanh (t cộ ử ệ ạ ể ộ ấ ố
đ hành nghìn km/s) trong khu v c xung quanh h t nhân t o thành m tộ ự ạ ạ ộ
đám mây electron. M t đ đi n tích c a đám mây này không đ u, khu v c có m t đ đi n tíchậ ộ ệ ủ ề ự ậ ộ ệ
l n nh t khu v c trong đó kh năng có m t electron là l n nh t. Ng i ta g i khu v c này làớ ấ ự ả ặ ớ ấ ườ ọ ự
obitan nguyên t .ử
Ch ng h n trong nguyên t hiđrô, electron có th có m t kh p n i trong vùng bao quanh h tẳ ạ ử ể ặ ắ ơ ạ
nhân t o thành đám mây electron, nh ng m t đ đi n tích c a đám mây electron đó l n nh t ạ ư ậ ộ ệ ủ ớ ấ ở
bên trong m t hình c u có đ ng kính là 1Å (h t nhân tâm). khu v c đó, kh năng có m tộ ầ ườ ạ ở Ở ự ả ặ
c a electron là l n nh t (t i 90%). Ta t ng t ng n u trong m t giây ta ch p đ c 1000 t mủ ớ ấ ớ ưở ượ ế ộ ụ ượ ấ
nh nguyên t hiđro thì trong 900 t m nh electron s có m t khu v c trên.ả ử ấ ả ẽ ặ ở ự
V sao trong nguyên t , m i electron l i có khu v c t n t i u tiên c a mình? Đó là do trongị ử ỗ ạ ự ồ ạ ư ủ
nguyên t , m i electron có m t năng l ng riêng.ử ỗ ộ ượ
b) L p electronớ
Trong nguyên t , h t nhân mang đi n tích d ng hút các electron mang đi n tích trái d u.ử ạ ệ ươ ệ ấ
Mu n tách electron ra kh i v nguyên t c n cung c p năng l ng cho nó. Th c nghi n ch ngố ỏ ỏ ử ầ ấ ượ ự ệ ứ
t r ng không ph i m i electron đ u liên k t v i h t nhân ch t ch nh nhau. Nh ng electronỏ ằ ả ọ ề ế ớ ạ ặ ẽ ư ữ
g n h t nhân nh t liên k t v i nhau ch t ch nh t. Ng i ta nói: chúng m c năng l ngở ầ ạ ấ ế ớ ặ ẽ ấ ườ ở ứ ượ
th p nh t. Ng c l i, nh ng electron xa h t nhân nh t có m c năng l ng cao nh t ; chúngấ ấ ượ ạ ữ ở ạ ấ ứ ượ ấ
d b tách ra kh i nguyên t h n các electron khác. Chính nh ng electron này quy đ nh tínhễ ị ỏ ử ơ ữ ị
ch t hoá h c c a các nguyên t .ấ ọ ủ ố
Tuỳ theo m c năng l ng cao hay th p mà các electron đ c phân b theo t ng l p electronứ ượ ấ ượ ố ừ ớ
(hay m c năng l ng). ứ ượ Các electron có m c năng l ng g n b ng nhau thu c cùng m t l p.ứ ượ ầ ằ ộ ộ ớ
Các l p electron t trong ra ngoài đ c đánh s n = 1, 2, 3, 4, .... ho c kí hi u b ng dãy chớ ừ ượ ố ặ ệ ằ ữ
cái l n: K, L, M, N ....ớ
c) Phân l p electron (hay phân m c năng l ng)ớ ứ ượ
M i l p electron l i phân chia thành phân l p electron. Các electron trong m i phân l p cóỗ ớ ạ ớ ỗ ớ
m c năng l ng b ng nhau.ứ ượ ằ
Các phân l p đ c kí hi u b ng các ch cái th ng s, p, d, f.ớ ượ ệ ằ ữ ườ
S phân l p b ng s th t c a l p.ố ớ ằ ố ứ ự ủ ớ
L p th 1 có 1 phân l p, đó là phân l p 1s.ớ ứ ớ ớ
L p th 2 có 2 phân l p, đó là phân l p 2s và phân l p 2p.ớ ứ ớ ớ ớ
L p th 3 có 3 phân l p, đó là phân l p 3s, 3p và phân l p 3d, v.v....ớ ứ ớ ớ ớ
Các electron phân l p s đ c g i là electron s ; phân l p p, đ c g i là electron p, v.v....ở ớ ượ ọ ở ớ ượ ọ
d) Obitan
Nguyên t hiđro. Electronử
chuy n đ ng r t nhanhể ộ ấ
trong khu v c xung quanhự
h t nhân t o thành m t đámạ ạ ộ
mây electron





![Bài tập so sánh hơn và so sánh nhất của tính từ [kèm đáp án/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250808/nhatlinhluong27@gmail.com/135x160/77671754900604.jpg)
![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)




![Tài liệu Lý thuyết và Bài tập Tiếng Anh lớp 6 [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250802/hoihoangdang@gmail.com/135x160/18041754292798.jpg)




