
Hóa hữu cơ
BKĐCMP – HKT
BKĐCMP -TL

Bài 1: Các khái niệm cơ bản trong HHC
1. Gốc hydrocacbon và các nhóm chức
2. Đồng đẳng, đồng phân
3. Các loại tác nhân phản ứng
4. Các loại phản ứng
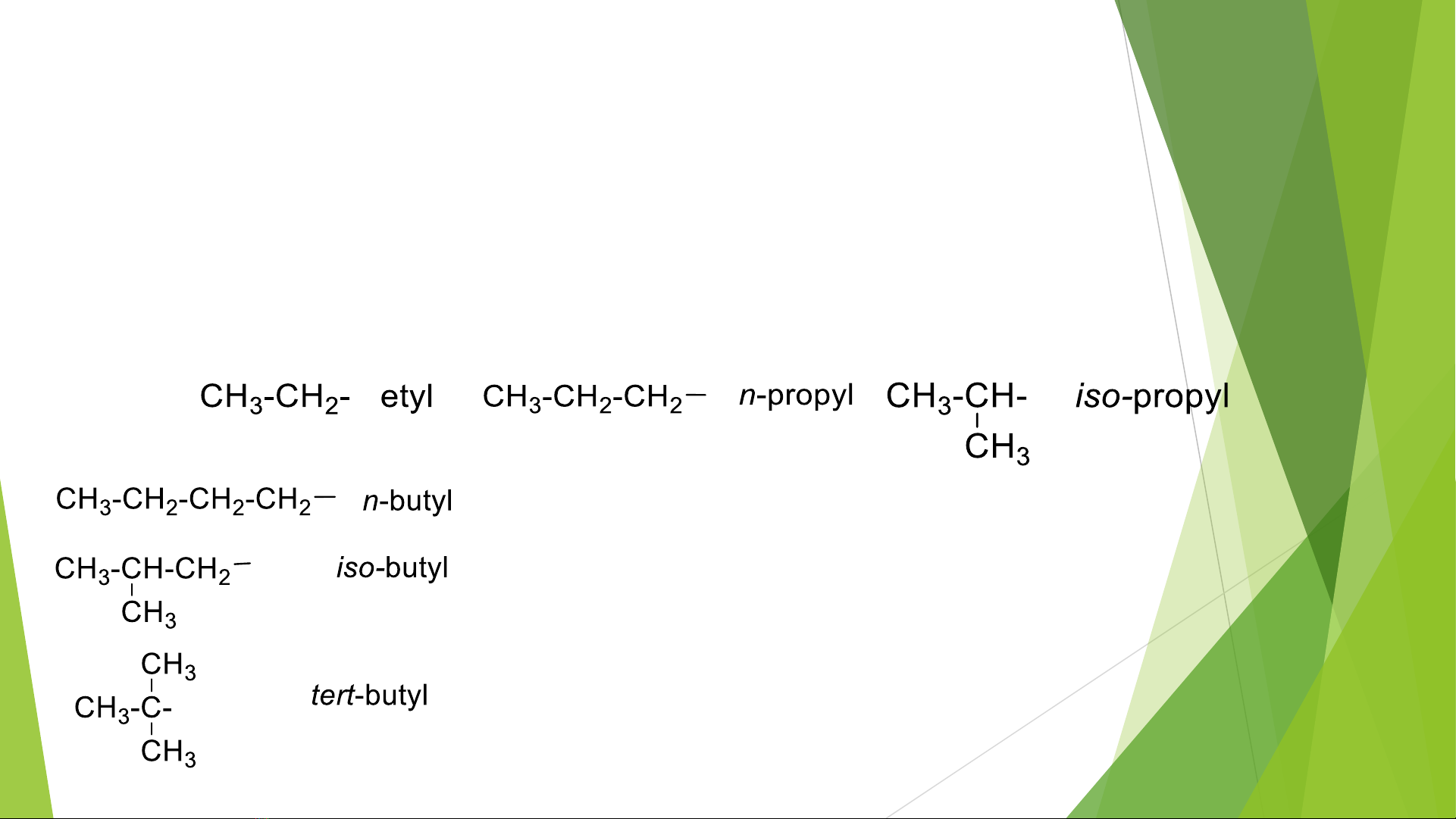
1.1, Gốc hydrocacbon
ĐN gốc hydrocacbon: là phần còn lại khi thay thế hoặc loại bỏ đi 1 ngtử H.
VD: Các gốc alkyl R -
CH4bỏ 1 H đi thành gốc ankyl CH3- : metyl
Tương tự:
Tiền tố:
n: chỉ mạch cacbon thẳng
Iso chỉ mạch nhánh và có nhóm (CH3)2CH-
tert: chỉ C bậc 3.
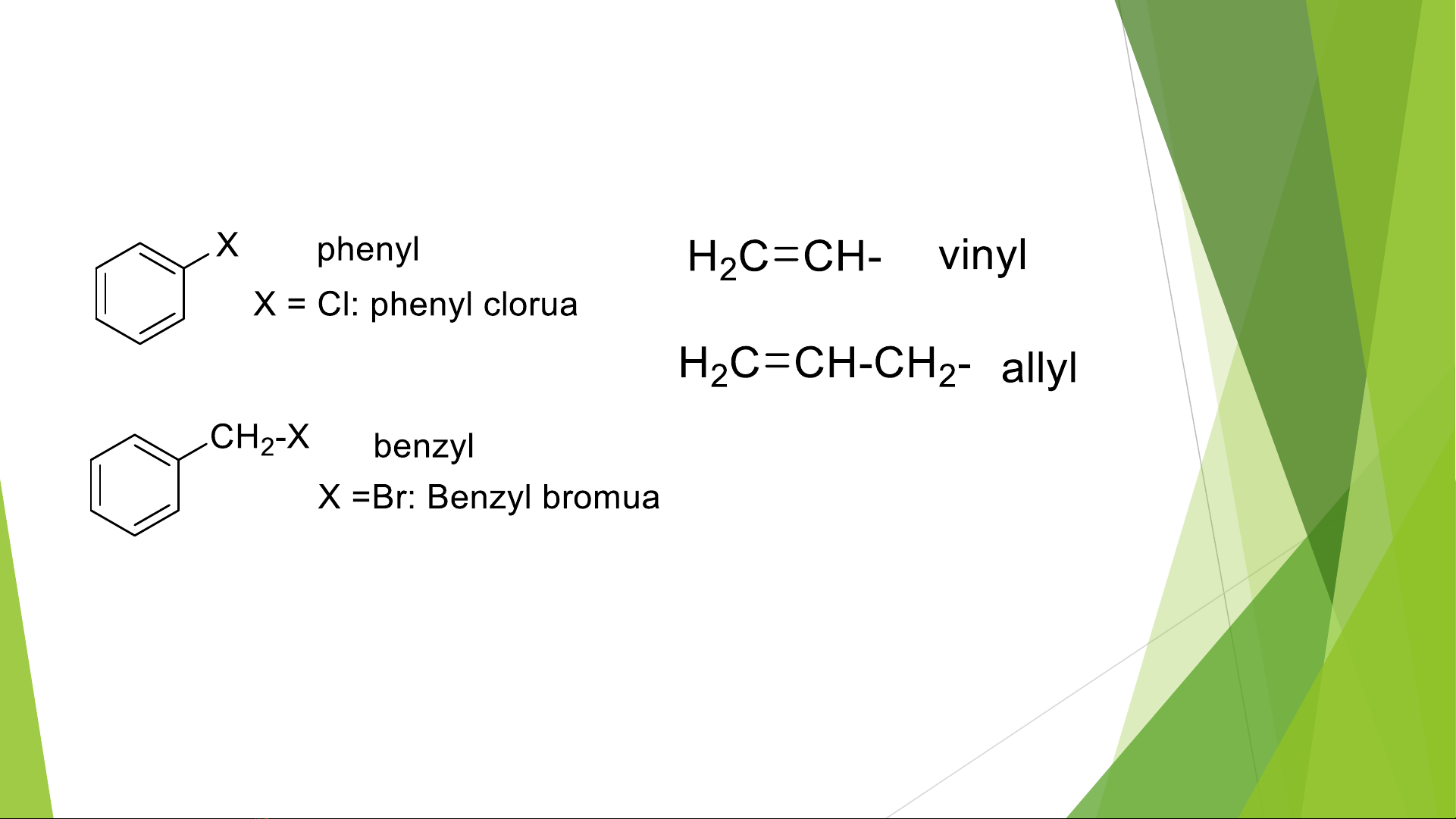
1.1, Gốc hydrocacbon
1 số gốc hidrocacbon không no thường gặp
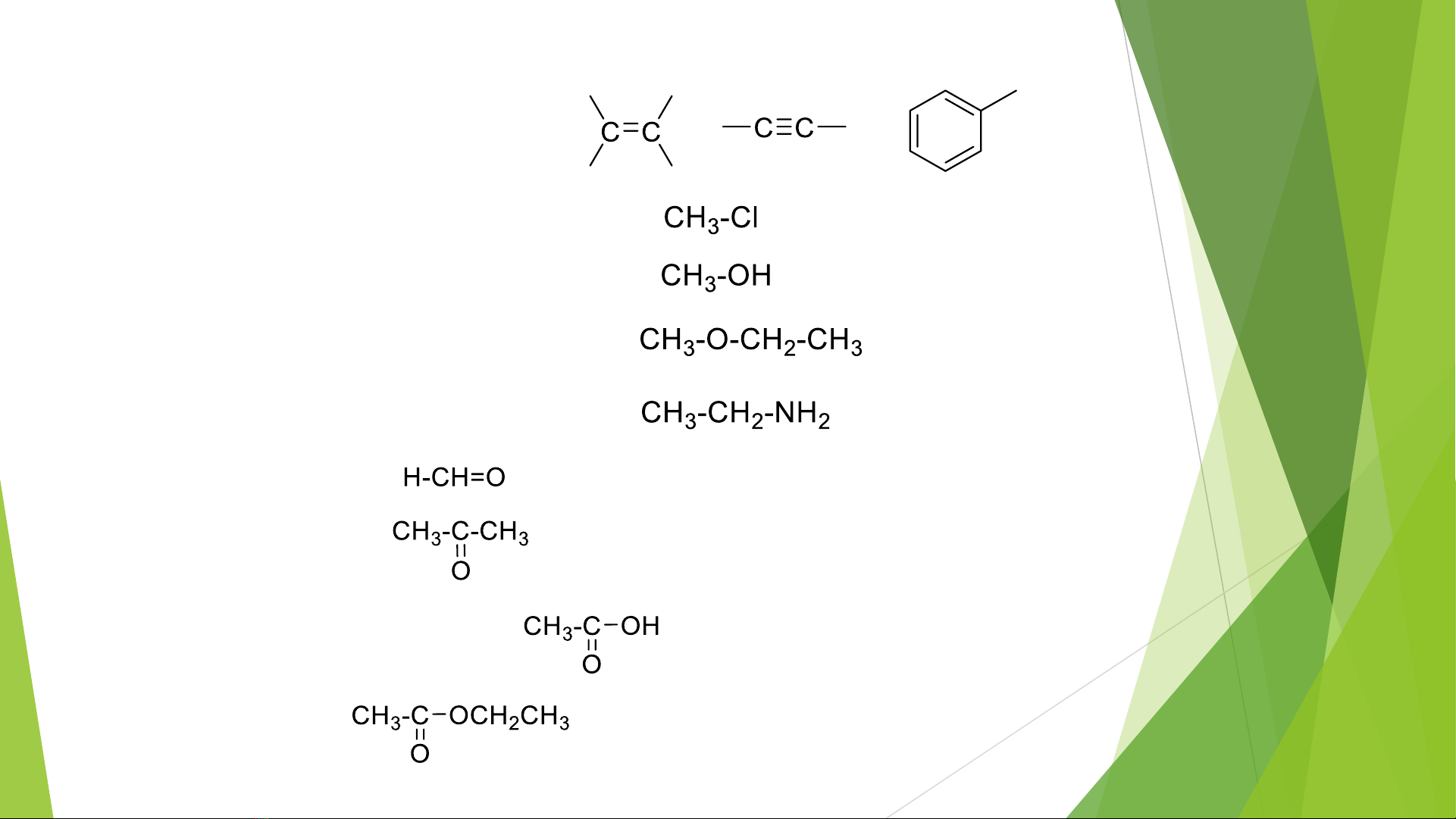
1.2, Các loại nhóm chức
a, liên kết bội: anken, ankin, aren
b, dẫn xuất halogen: C-X, X= F, Cl, Br, I
c, Ancol: C-OH
d, Ete : C-O-C
e, Amin: C-N
f, Andehit: R-CH=O
g, Xeton: R-C(R)=O
h, Axit cacboxylic: R-COOH
i, este: RCOOR’




![Bài giảng Hóa hữu cơ 1: Phần 2 - ĐH Võ Trường Toản (GV. Nguyễn Hoàng Sơn) [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2023/20230606/loivokiet/135x160/802300288.jpg)


![Bài giảng Hóa hữu cơ 1: Phần 1 - ĐH Võ Trường Toản (GV. Lê Vinh Bảo Châu) [Chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2023/20230606/loivokiet/135x160/1932011819.jpg)






![Đề thi kết thúc học phần Nguyên lí Hóa học 2 [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251014/anhinhduyet000/135x160/69761760428591.jpg)











