GV. Lê Th Xuân H ngị ươ
CH NG 3:ƯƠ LIÊN K T HÓA H CẾ Ọ
3.1. Liên k t ion theo Kossel ế(Côtxen)
- Là l c hút tĩnh đi n gi a các ion trái d u ( th ng hình thành gi a các kim lo i đi n hìnhự ệ ữ ấ ườ ữ ạ ể
v i các phi kim đi n hình)ớ ể
+ Gi i thích:ả
Phân t c a h p ch t hóa h c đ c t o nên nh s chuy n electron hóa tr t nguyên t nàyử ủ ợ ấ ọ ượ ạ ờ ự ể ị ừ ử
sang nguyên t kia.ử
Nguyên t m t electron bi n thành ion d ng ( G i là cation)ử ấ ế ươ ọ
Nguyên t thu electron bi n thành ion âm (G i là anion)ử ế ọ
Sau đó các ion mang đi n tích ng c d u đó hút nhau và l i g n nhau, nh ng khi đ n r tệ ượ ấ ạ ầ ư ế ấ
g n nhau gi a nh ng ion đó xu t hi n l c đ y sinh ra b i t ng tác gi a v electron c a cácầ ữ ữ ấ ệ ự ẩ ở ươ ữ ỏ ủ
ion. L c đ y đó càng tăng lên khi các ion càng g n nhau, đ n lúc l c đ y b ng l c hút, cácự ẩ ầ ế ự ẩ ằ ự
ion d ng l i và cách nhau m t kho ng nh t đ nh, khi đó liên k t ion đ c hình thành.ừ ạ ở ộ ả ấ ị ế ượ
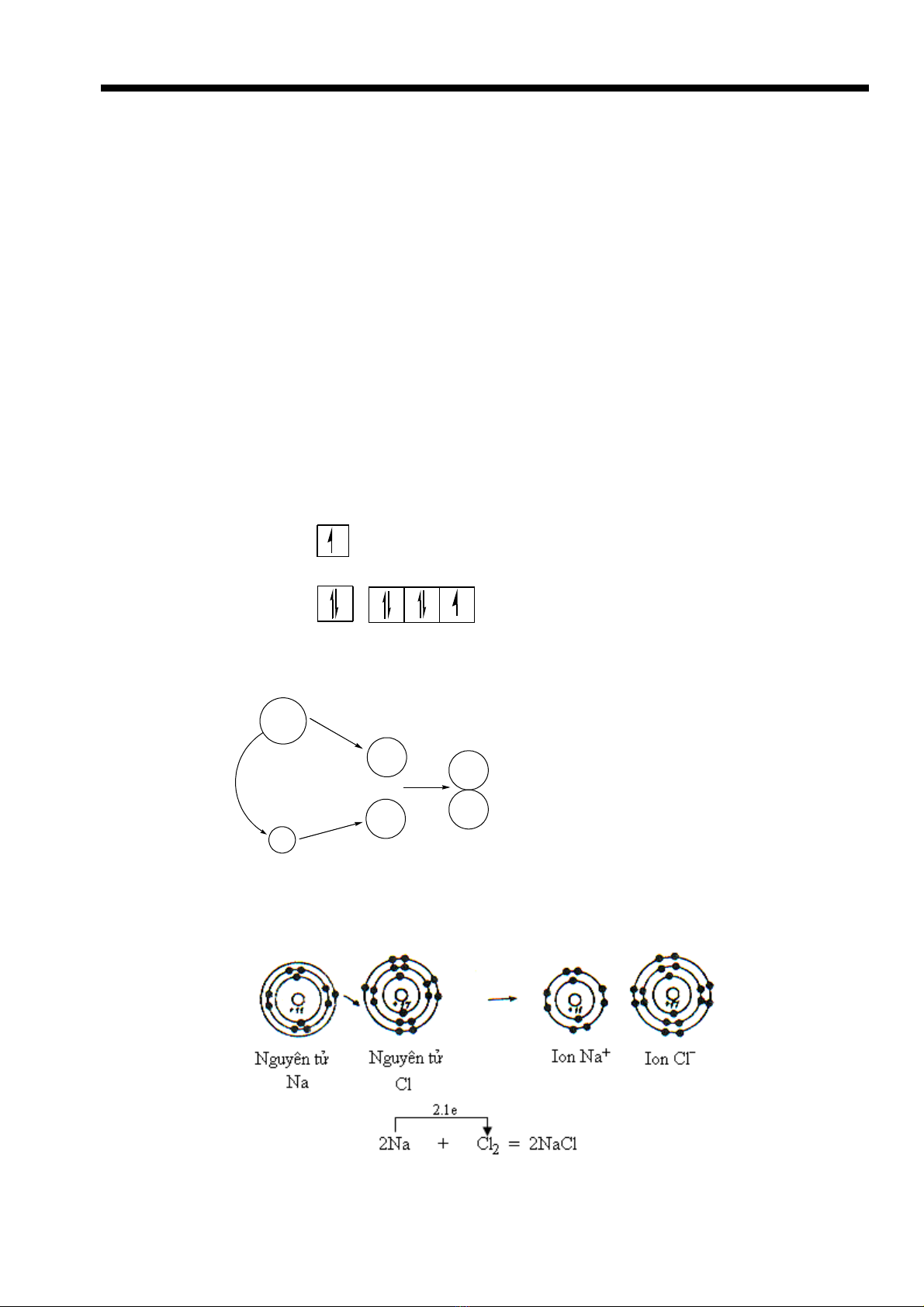
VD: Quá trình hình thành phân t NaClử
+ Nguyên t Na (Z=11): ử[Ne]3s1
+ Nguyên t Cl ( Z = 17): [Ne]3sử23p5
+ Na – 1e- → Na+ (Cation)
+ Cl + 1e- → Cl- (Anion)
Na
Cl
Na
Cl
-
Na
+
Cl-
1e
-
Sau khi Na m t electron bi n thành Naấ ế + thì bán kính nh đi còn Cl nh n electron bi n thànhỏ ậ ế
Cl- thì bán kính l n h n so v i tr ng thái nguyên t trung hòa.ớ ơ ớ ở ạ ử
Hai ion Na+ và Cl- hút nhau b ng l c hút tĩnh đi n, chúng s ti p xúc nhau m t kho ng cáchằ ự ệ ẽ ế ộ ả
b ng t ng bán kính c a hai ionằ ổ ủ
- H n ch : ạ ế
Trang: 1
GV. Lê Th Xuân H ngị ươ
Không gi i thích đ c s t o thành m t s r t l n phân t t o nên b i nguyên t c a cùngả ượ ự ạ ộ ố ấ ớ ử ạ ở ử ủ
m t nguyên t nh Clộ ố ư 2, H2…ho c c a nh ng nguyên t g n gi ng nhau nh SOặ ủ ữ ố ầ ố ư 2, CO2…
3.2. Liên k t c ng hóa tr theo Lewis ế ộ ị (Liuyt)
- Là liên k t b ng c p electron chungế ằ ặ
Gi i thích:ả
Các nguyên t đ a ra nh ng electron hóa tr c a mình t o thành 1,2 hay 3 c p electron chungử ư ữ ị ủ ạ ặ
gi a hai nguyên t đ m i nguyên t đ t đ c c u hình electron b n c a khí hi m nsữ ử ể ỗ ử ạ ượ ấ ề ủ ế 2 hay
ns2np6.
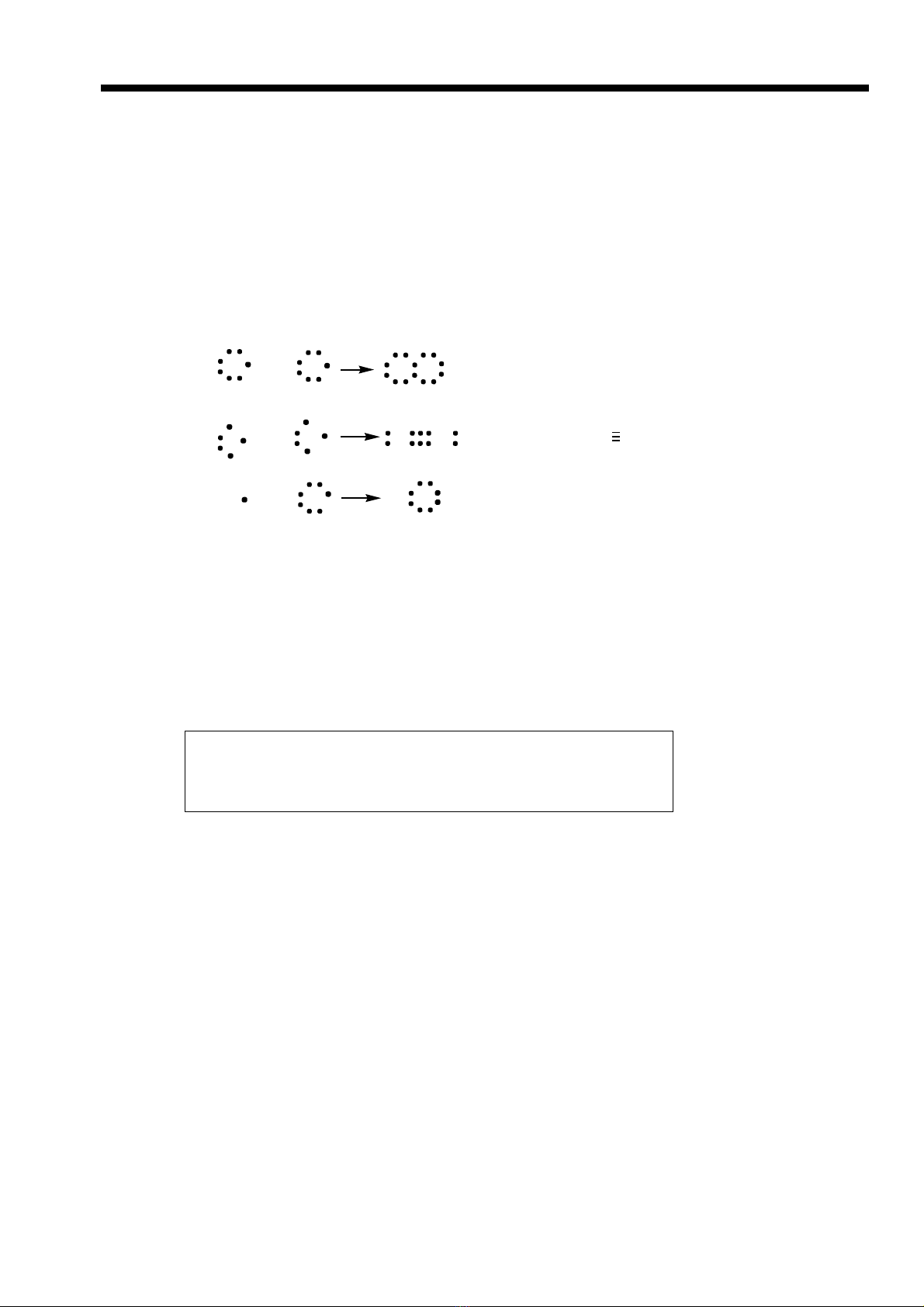
VD: Công th c electron Công th c c u t oứ ứ ấ ạ
Cl Cl Cl Cl ( Cl- Cl )
N
+
+N N N ( N N)
Cl+
HClH ( H - Cl)
N u thay m i c p electron chung b ng m t v ch n i ta có công th c c u t o.ế ỗ ặ ằ ộ ạ ố ứ ấ ạ
- Có hai lo i liên k t c ng hóa tr :ạ ế ộ ị
* Liên k t c ng hóa tr không c c:ế ộ ị ự C p electron chung gi a hai nguyên t o nên liên k tặ ữ ạ ế
thu c v hai nguyên t v i m c đ nh nhau. ộ ề ử ớ ứ ộ ư VD: H2, Cl2 (H-H)
* Liên k t c ng hóa tr có c c:ế ộ ị ự C p electron chung l ch v phía nguyên t c a nguyênặ ệ ề ử ủ
t có đ âm đi n l n h n. ố ộ ệ ớ ơ VD: Trong phân t HCl thì c p electron chung l ch v phíaử ặ ệ ề
Clo.
⇒Liên k t c ng hóa tr không phân c c và liên k t ionế ộ ị ự ế
là hai tr ng h p gi i h n c a liên k t c ng hóa trườ ợ ớ ạ ủ ế ộ ị
có c cự
- H n ch :ạ ế
Không gi i thích đ c:ả ượ
C u trúc c a các phân t không tuân theo quy t c “bát t ” nh BeClấ ủ ử ắ ử ư 2, BeCl3….
Góc gi a hai nguyên t t o liên k t ữ ử ạ ế
S hi n di n c a các phân t có s electron l . VD: BeClự ệ ệ ủ ử ố ẻ 3
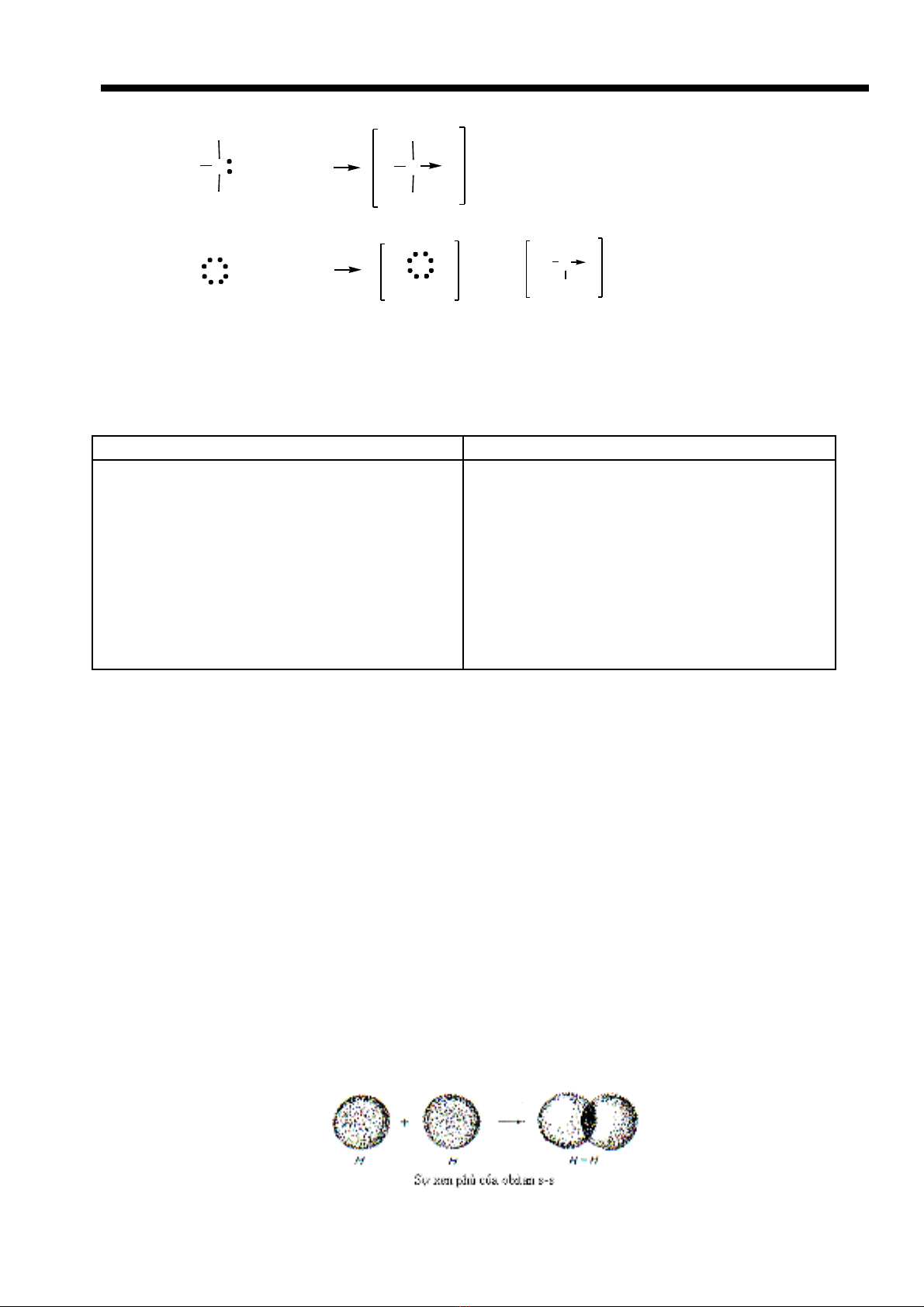
Liên k t ph i tríế ố (Liên k t cho - nh n)ế ậ
- Là liên k t c ng hóa tr nh ng trong đó c p electron chung do m t nguyên t đóng gópế ộ ị ư ặ ộ ử
( th ng dùng mũi tên→ đ ch liên k t cho - nh n)ườ ể ỉ ế ậ
VD:
Trang: 2
GV. Lê Th Xuân H ngị ươ
N
H
H
H+ H
+
N
H
H
HH
+
(NH
4+
)
O
H
H
+ H
+
O
H
H
H
+
hay
OH
H
H
+
(H
3
O
+)
⇒ Đi n tích d ng tr thành đi n tích chung c a c ion Hệ ươ ở ệ ủ ả 3O+ và c a c ion NHủ ả 4+ ch khôngứ
thu c nguyên t Hyđro nào cộ ử ả
So sánh hai lo i liên k tạ ế
Liên k t ionếLiên k t c ng hóa trế ộ ị
- Liên k t b ng l c hút tĩnh đi nế ằ ự ệ
- Th ng liên k t ion hình thành gi a haiườ ế ữ
nguyên t c a nguyên có đ âm đi n khácử ủ ộ ệ
nhau nhi u.ề
VD: Gi a kim lo i đi n hình và phi kimữ ạ ể
đi n hình nh NaClể ư
- Có nhi t đ nóng ch y và nhi t đ sôiệ ộ ả ệ ộ
cao
- Không có h ngướ
- Liên k t b ng c p electron chungế ằ ặ
- Liên k t th ng hình thành gi a haiế ườ ữ
nguyên t c a nguyên t có đ âm đi nử ủ ố ộ ệ
gi ng ho c khác nhau không nhi u. ố ặ ề
VD: H2, HCl
- Có nhi t đ nóng ch y và nhi t đ sôiệ ộ ả ệ ộ
th p.ấ
- Có h ngướ
3.3. Ph ng pháp liên k t hóa tr (VB) ươ ế ị (Valence – bond)
Thuy t tĩnh đi n c a Côtxen cũng nh thuy t c p electron c a Liuyt đ u ch a gi i thích rõế ệ ủ ư ế ặ ủ ề ư ả
và đ y đ v đ b n c a liên k t và hình h c c a phân t . Hai thuy t g n đúng đ c sầ ủ ề ộ ề ủ ế ọ ủ ử ế ầ ượ ử
d ng r ng rãi đ gi i thích b n ch t c a liên k t c ng hóa tr nói riêng hay c a liên k t hóaụ ộ ể ả ả ấ ủ ế ộ ị ủ ế
h c nói chung là thuy t liên k t hóa tr ( vi t t t là thuy t VB) và thuy t oribitan phân tọ ế ế ị ế ắ ế ế ử
( vi t t t là thuy t MO).ế ắ ế
3.3.1. M t s lu n đi m c b nộ ố ậ ể ơ ả
Thuy t VB xu t phát t nh ng lu n đi m sau:ế ấ ừ ữ ậ ể
Lu n đi m 1:ậ ể
Liên k t hình thành là do s k t đôi c a hai electron spin trái d u. đây s có s xen phế ự ế ủ ấ Ở ẽ ự ủ
c a hai orbitan nguyên t c a hai nguyên t , m i orbitan mang m t electron. V y khi t oủ ử ủ ố ỗ ộ ậ ạ
thành phân t các nguyên t v n gi nguyên ki n trúc electron.ử ử ẫ ữ ế
VD: Khi hai nguyên t Hyđro có ch a electron spin trái d u ti n g n đ n nhau thì chúng hútử ứ ấ ế ầ ế
nhau làm năng l ng c a h gi m xu ng thì h tr thành v ng b n. Lúc này liên k t hóa h cượ ủ ệ ả ố ệ ở ữ ề ế ọ
xu t hi n do hai electron spin ng c d u có th chuy n đ ng g n c hai h t nhân, nói cáchấ ệ ượ ấ ể ể ộ ầ ả ạ
khác là hai electron này tr thành chung cho c hai h t nhân nguyên t Hyđroở ả ạ ử
⇒ Liên k t c ng hóa tr đ c g i là liên k t hai electron hai tâm.ế ộ ị ượ ọ ế
Trang: 3

GV. Lê Th Xuân H ngị ươ
Lu n đi m 2:ậ ể
Đi u ki n đ t o liên k t hóa h c gi a hai nguyên t là chúng có nh ng electron đ c thân đề ệ ể ạ ế ọ ữ ử ữ ộ ể
có th ghép đôi đ c.ể ượ
VD:
Li : 1s22s1
⇒ Vì có 1 electron đ c thân nên Li có th t o đ c 1 liên k tộ ể ạ ượ ế
C: 1s22s22p2
Sau khi nh n năng l ng thì C tr ng thái kích thích ậ ượ ở ạ
2s 2p
C
*
1s
2
2s
1
2p
3
⇒Vì có 4 electron đ c thân nên Cacbon có th t o đ c 4 liên k tộ ể ạ ượ ế
O: 1s22s22p4
⇒ Vì có 2 electron đ c thân nên O t o đ c 2 liên k t.ộ ạ ượ ế
Lu n đi m 3:ậ ể
M c đ xen ph c a các orbitan càng l n thì liên k t c ng hóa tr càng b n. M c đ này phứ ộ ủ ủ ớ ế ộ ị ề ứ ộ ụ
thu c vào các y u t sau:ộ ế ố
+ Kích th c, hình d ng orbitan (s, p, d, f)ướ ạ
+ H ng xen ph theo tr c hay song songướ ủ ụ
+ Ki u xen ph ể ủ
3.3.2. Tính có h ng c a liên k t c ng hóa tr . ướ ủ ế ộ ị
M i liên k t c ng hóa tr trong phân t đ c phân b theo nh ng ph ng sao cho s xen phỗ ế ộ ị ử ượ ố ữ ươ ự ủ
c a các orbitan nguyên t là l n nh t.ủ ử ớ ấ
VD1:
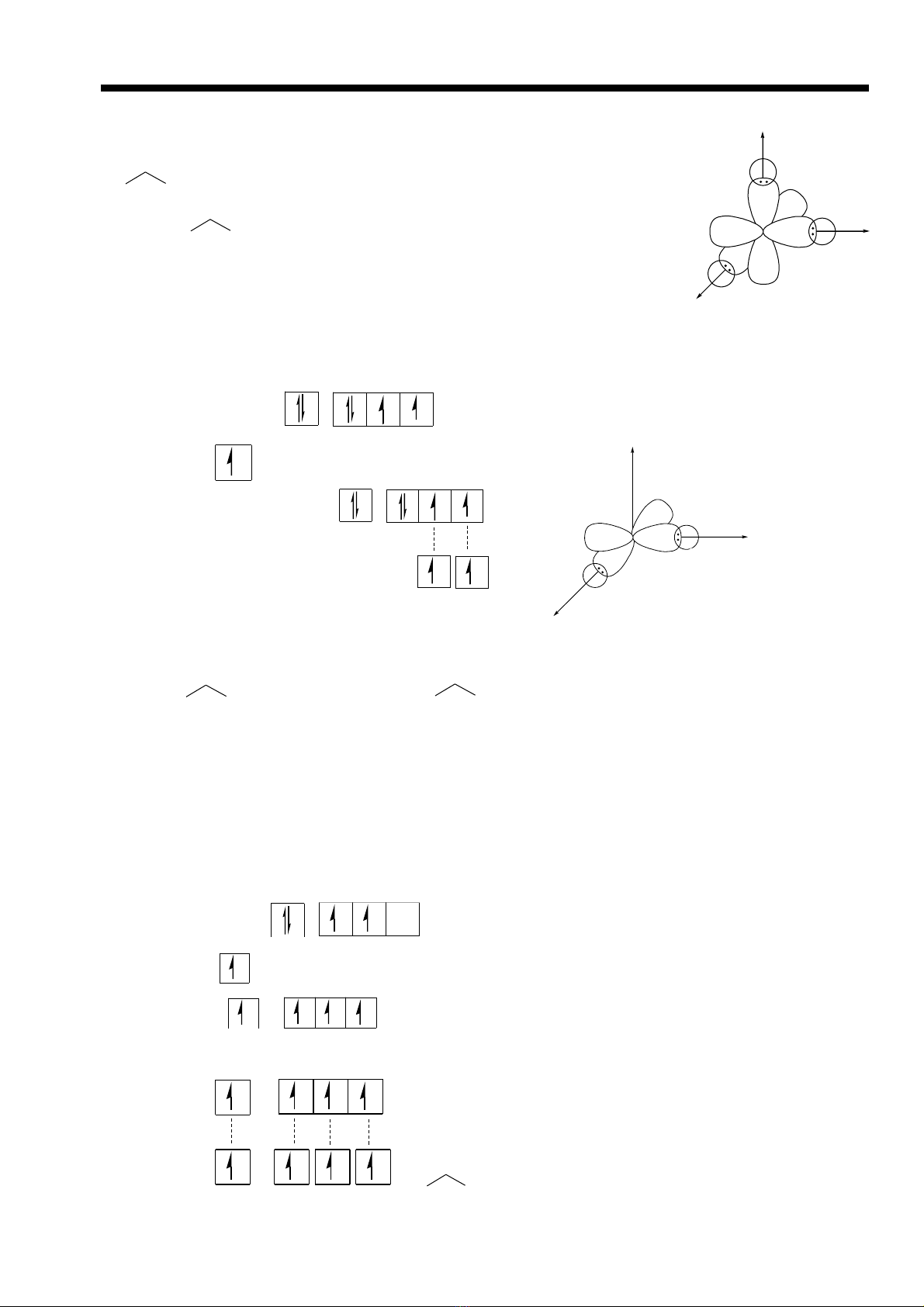
Gi i thích phân t PHả ử 3 theo thuy t VB ế
B1: Vi t c u trúc electron c a các nguyên tế ấ ủ ử
P(Z=15): [Ne]3s23p3
H(Z=1): 1s1
B2: Các orbitan ch a electron đ c thân s l n l t xen ph v i nhau đ t o thành liênứ ộ ẽ ầ ượ ủ ớ ể ạ
k tế
Trang: 4
2s 2p
2s 2p
S
H
H
x
y
z
GV. Lê Th Xuân H ngị ươ
M i orbitan p c a P s liên k t v i m t orbitan 1s c a H ỗ ủ ẽ ế ớ ộ ủ ⇒ T oạ
thành 3 liên k t P-Hế
Góc = 900 (góc lý thuy t theo VB)ế
Th c tê góc = 93ự0(góc th c nghi m)ự ệ
Góc th c nghi m l n h n góc lý thuy t 30, là do s đ y nhau c a cácự ệ ớ ơ ế ự ẩ ủ
nguyên t H và c a các đôi electron tham gia liên k t.ử ủ ế
VD2: Gi i thích c u trúc phân t Hả ấ ử 2S theo thuy t VBế
S (Z=16) [Ne]3s23p4
H (Z=1) 1s1
T o thành hai liên k t S-Hạ ế
Theo thuy t VB, nguyên t H s ti n t i nguyên t S theo 2 ph ng c a Sx và Sy, đ có sế ử ẽ ế ớ ố ươ ủ ể ự
che ph c c đ i gi a orbitan s c a nguyên t H và orbitan px, py ( ch ng h n) c a nguyên t S.ủ ự ạ ữ ủ ử ẳ ạ ủ ử
Theo thuy t VB: ế
Th c t góc = 90ự ế 0 nh ng th c t góc = 92ư ự ế 0
* u - Khuy t đi m c a thuy t VB:Ư ế ể ủ ế
Thuy t VB có th gi i thích đ c góc c a liên k t, tuy nhiên so v i th c t thì góc này cònế ể ả ượ ủ ế ớ ự ế
ch a phù h p. Thuy t này đã dùng s đ y nhau gi a đôi electron liên k t và nguyên t liênư ợ ế ự ẩ ữ ế ử
k t v i nguyên t trung tâm. Tuy nhiên còn nhi u tr ng h p thì so v i th c t còn l ch quáế ớ ử ề ườ ợ ớ ự ế ệ
xa. Đ i v i các phân t h p ch t c a C, Si…thì v n đ còn khó khăn h n n a.ố ớ ử ợ ấ ủ ấ ề ơ ữ
VD: Gi i thích c u trúc phân t CHả ấ ử 4 theo thuy t VBế
C (Z= 6) 1s22s22p2
H (Z= 1) 1s1
C*: 1s22s12p3
4 orbitan này s liên k t v i 4 orbitan s c a H t o thành 4 liên k t C-Hẽ ế ớ ủ ạ ế
Theo thuy t VB thì 3 liên k t C-H có góc = 90ế ế 0
Trang: 5
HPH
HSH
HSH
HCH
HPH
P
H
H
H
x
y
z





![Bài tập so sánh hơn và so sánh nhất của tính từ [kèm đáp án/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250808/nhatlinhluong27@gmail.com/135x160/77671754900604.jpg)
![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)




![Tài liệu Lý thuyết và Bài tập Tiếng Anh lớp 6 [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250802/hoihoangdang@gmail.com/135x160/18041754292798.jpg)




